無水氯化鈣經熔鹽電解產出金屬鈣的過程,是工業上生產鈣的主要方法,包括氯化鈣制取和氯化鈣熔鹽電解兩大環節。
無水氯化鈣制取
熔鹽電解法生產金屬鈣所用的原料是無水氯化鈣,無水氯化鈣制取有石灰石鹽酸溶解和氯氣堿液吸收兩種方法。
石灰石鹽酸溶解法
主要由石灰石溶解、溶液凈化、過濾、干燥等作業組成。將含CaCO3在95.5%以上的優質石灰石溶于含HCl31%的溶液中,發生生成CaCl2反應:
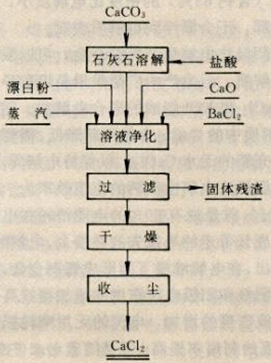
氯化鈣工藝制取流程圖
CaCO3+2HCl === CaCl2+CO2+H2O
石灰石中的鎂、鐵、錳等雜質也同時溶入溶液,生成相應的MgCl2 、FeCl2 、MnCl2。將溶液加熱至358~363K,為使鐵完全沉淀析出,先用漂白粉將FeCl2氧化成FeCl3,然后加入石灰乳中和溶液中的游離酸至溶液pH達到7~8。溶液中的鎂、鐵、錳等氯鹽雜質,在溶液pH=7~8的條件下,發生水解生成的SO42- :用加BaCl2使之生成BaSO4沉淀而除去。經過濾、分離、沉淀后的凈化溶液在533~573K溫度熱空氣的干燥塔中脫水。產出的脫水氯化鈣含CaCl2>92%、SO42-≤0.06%、Fe≤0.004%、堿金屬和鎂≤0.15%、水分≤8.0%。


